溶液电导的测定——测HAc的电离平衡常数
一、实验目的
(1)掌握电导测定的原理和电导率仪的使用方法;
(2)通过实验验证电解质溶液电导率与浓度的关系;
(3)掌握电导法测定弱电解质的电离平衡常数的原理和方法。
二、实验原理
电解质溶液属于第二类电子导体,它是靠正负离子的定向迁移传递电流,溶液的导电本领可用电导率来表示。
将电解质溶液放入两平行电极之间,两电极距离为 [m],两电极面积均为A[m2],这时溶液的电阻是:
[m],两电极面积均为A[m2],这时溶液的电阻是:

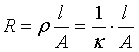
所以
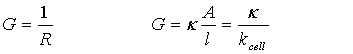 (1)
(1)
电导池常数或电极常数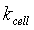 可用标准溶液(常用氯化钾溶液)标定。用已知电导率
可用标准溶液(常用氯化钾溶液)标定。用已知电导率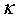 的氯化钾溶液放入电导池中,在测定其电阻
的氯化钾溶液放入电导池中,在测定其电阻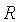 之后,即可求得电导池常数
之后,即可求得电导池常数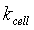 。应用同一个电导池,便可通过电阻的测量求其它电解质溶液的电导率。
。应用同一个电导池,便可通过电阻的测量求其它电解质溶液的电导率。
溶液的摩尔电导率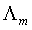 是指把含有1mol 电解质的溶液置于相距为 1m 的两平行电板电极之间的电导,其单位为S·m2·mol-1。摩尔电导率与电导率和浓度的关系为:
是指把含有1mol 电解质的溶液置于相距为 1m 的两平行电板电极之间的电导,其单位为S·m2·mol-1。摩尔电导率与电导率和浓度的关系为:
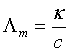 (2)
(2)
无限稀释摩尔电导率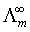 :溶液在无限稀释时的摩尔电导率,无论强弱电解质,此时均全部电离,符合离子独立移动定律:
:溶液在无限稀释时的摩尔电导率,无论强弱电解质,此时均全部电离,符合离子独立移动定律: 。
。
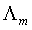 随浓度变化的规律,对强弱电解质各不相同,对强电解质稀溶液可用下列经验公式表示:
随浓度变化的规律,对强弱电解质各不相同,对强电解质稀溶液可用下列经验公式表示:
 (3)
(3)
将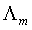 对
对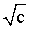 作图,外推可求得
作图,外推可求得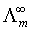 。
。
对弱电解质来说,可以认定它的电离度 等于溶液在浓度为c时的摩尔电导率
等于溶液在浓度为c时的摩尔电导率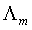 和溶液在无限稀释时的摩尔电导率
和溶液在无限稀释时的摩尔电导率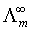 之比,即:
之比,即:
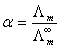 (4)
(4)
AB型弱电解质在溶液中电离达到平衡时,电离平衡常数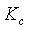 与浓度c和电离度
与浓度c和电离度 有以下关系:
有以下关系:
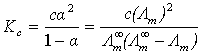
可改写为直线方程: 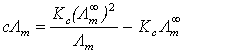 (5)
(5)
以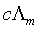 对
对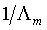 作图为一直线,从直线斜率和截距可求得
作图为一直线,从直线斜率和截距可求得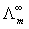 和
和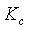 。按照标准写法,c应为
。按照标准写法,c应为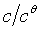 ,
,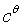 为1mol·dm-3,
为1mol·dm-3,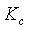 应为
应为 。
。
电导率的测定不仅可以用来测定弱电解质的电离度和电离平衡常数,还可以用来测定难溶盐的溶解度、电导滴定等。
三、实验仪器与试剂
1、仪器
电导率仪1台,恒温水浴装置1套,容量瓶(100mL)5只,移液管(25mL、50mL)各1支,洗瓶1只,洗耳球1只。
2、实验试剂
KCl标准溶液(0.1mol·L-1),醋酸标准溶液(0.1 mol·L-1),电导水。
四、实验步骤
(1)将恒温水浴温度调至(25.0±0.1)℃或(30.0±0.1)℃。
(2)测定电导池常数Kcell
倾去电导池中蒸馏水(电导池不用时,应把两铂黑电极浸在蒸馏水中,以免干燥致使表面发生改变)。将电导池和铂电极用少量的0.1mol·L-1 KCl溶液洗涤2-3次后,装入0.1mol·L-1 KCl溶液,恒温后,用电导率仪测其电导率,重复测定三次。
(3)测定电导水的电导率
倾去电导池中的KCl溶液,用电导水洗净电导池和铂电极,然后注入电导水,恒温后测其电导率,重复测定三次。
(4)测定HAc溶液的电导率
①倾去电导池中电导水,将电导池和铂电极用电导水洗净吹干,在电导池中注入25mL 0.1mol·L-1 HAc溶液,插入干净干燥的铂电极。恒温十分钟,用电导率仪测其电导率,测至三次读数接近为止,求这三次的平均值。
②用移液管吸取25mL电导水注入电导池,此时溶液浓度为原始浓度的 均匀混合后恒温十分钟,用同样的方法测定其电导率。
均匀混合后恒温十分钟,用同样的方法测定其电导率。
③用移液管从电导池中吸出25mL弃去,用另一移液管再取25mL电导水注入,均匀混合后恒温十分钟,此时溶液的浓度为原来的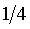 ,用同样的方法测定其电导率。
,用同样的方法测定其电导率。
④重复上述③操作,依次测定浓度为原溶液的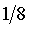 ,
,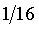 的电导率。
的电导率。
(5)测定强电解质的电导率
按照4的操作,依次测定不同浓度的KCl溶液的电导率。
五、注意事项
(1)实验中温度要恒定,测量必须在同一温度下进行。
(2)测定溶液电导率前,都必须将电导电极及电导池洗涤干净,并用待测液润洗2~3次,以免影响测定结果。而本实验步骤4、5中,溶液浓度的准确是要依靠体积的准确来保证,此时电导电极及电导池洗涤干净后就不能用待测液润洗,而应吹干。
六、实验记录与处理
1、实验数据记录
室温: 气压: 恒温水浴温度:

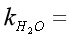 :
:
2、数据处理:
(1)计算电导池常数Kcell。
(2)计算各浓度的醋酸溶液的真实电导率。
(3)根据公式(2)计算醋酸和氯化钾在各浓度下的摩尔电导率。
(4)计算醋酸在各个浓度下的电离度a,计算电离平衡常数Kc。
(5)按公式(4)以cΛm对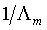 作图应得一直线,由直线的斜率和截距可求得
作图应得一直线,由直线的斜率和截距可求得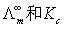 ,查阅相应的文献值,比较实验值与文献值,进行误差分析。
,查阅相应的文献值,比较实验值与文献值,进行误差分析。
(6)以KCl溶液的Λm对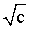 作图,外推求
作图,外推求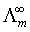 ,并与文献值比较。
,并与文献值比较。
七、思考题
(1)为什么要测电导池常数?如何得到该常数?
(2)测电导时为什么要恒温?实验中测电导池常数和溶液电导率,温度是否要一致?
(3)设计一个实验,用电导法测定难溶盐PbSO4的溶解度,并写出实验方案。
参考文献
[1] 傅献彩,沈文霞,姚天扬.物理化学(下册,第五版)[M].北京:高等教育出版社,2006.
[2] 东北师范大学等校编.物理化学实验(第二版)[M].北京:高等教育出版社1982.
[3] W·J·Moore 编.江逢霖等译.基础物理化学[M].上海:复旦大学出版社,1992.
[4] P.W.Atkins, J.de. Paula, Atkins’ Physical Chemistry, 8th ed[M]. Oxford University Press 2006.
附录一 电导率仪的使用:
1、仪器量程显示范围
本仪器设有四档量程。当选用电导池常数J0=1电极测量时,其量程显示范围如表1。
表 78-1 J0=1时仪器各量程段对应量程显示范围 (μS ·cm-1)
序号 |
量程开关位置 |
仪器显示范围 |
对应量程显示范围 |
1 |
20μS |
0~19.99 |
0~19.99 |
2 |
200μS |
0~199.9 |
0~199.9 |
3 |
2mS |
0~1.999 |
0~1999 |
4 |
20mS |
0~19.99 |
0~19990 |
注:量程1、2档,单位μS·cm-1;量程3、4档,单位mS·cm-1。
2、电导池常数测定方法
配制电导率标准溶液。标准物质用氯化钾,按表2要求配制。
清洗、清洁待测电极,接入仪器,插入溶液。 测量开关置“校正”档,调节常数校正钮,使仪器显示1.00。测量开关置 “电导”档,读出仪器读数D表。
计算:J待=K标/D表:
J待:待测电极的电导池常数,单位cm-1;
K标:标准溶液电导率,由表2查得,单位S·cm-1;
D表:仪器显示读数,单位μS或mS,由仪器所用量程档得。
(计算时, J待与K标应统一单位。用μS·cm-1或mS·cm-1)
表 78-2 电导率标准溶液浓度及其电导率值(15℃-35℃)
编号 |
KCl溶液/mol·L-1 |
电导率(S·cm-1) |
15℃ |
18℃ |
20℃ |
25℃ |
35℃ |
1 |
1 |
0.09212 |
0.09780 |
0.10170 |
0.11131 |
0.13110 |
2 |
0.1 |
0.010455 |
0.011162 |
0.011644 |
0.012852 |
0.015353 |
3 |
0.01 |
0.0011414 |
0.0012200 |
0.0012737 |
0.0014083 |
0.0016876 |
4 |
0.001 |
0.0001185 |
0.0001267 |
0.0001322 |
0.0001465 |
0.0001765 |
3、测量
选择合适规格常数电极,根据电极实际电导池常数,仪器进行常数校正。经校正后,仪器可直接测量液体电导率。将测量开关置“测量”档,选用适当的量程档,将清洁的电极插入被测液中,仪器显示该被测液在溶液温度下的电导率。
4、仪器维护和注意事项
(1)电极应置于清洁干燥的环境中保存。
(2)电极在使用和保存过程中,因受介质、空气侵蚀等因素的影响,其电导池常数会有所变化。电导池常数发生变化后,需重新进行电导池常数测定(测定方法见电导池常数测定方法” )。仪器应根据新测得的常数重新进行 “常数校正”。
(3)测量时,为保证样液不被污染,电极应用去离子水(或二次蒸馏水)冲洗干净,并用样液适量冲洗。
(4)当样液介质电导率小于1μS·cm-1时,应加测量槽作流动测量。
(5)选用仪器量程档应参照表1。能在低一档量程内测量的,不放在高一档测量。在低档量程内,若已超量程,仪器显示屏左侧第一位显示1(溢出显示)。此时,请选高一挡测量。
附录二 水的处理
重蒸馏水:蒸馏水是电的不良导体。但由于溶有杂质,如二氧化碳和可溶性固体杂质,它的电导显得很大,影响电导测量的结果,因而需对蒸馏水进行处理。
处理的方法是,向蒸馏水中加入少量高锰酸钾,用硬质玻璃烧瓶进行蒸馏。本实验要求水的电导率应小于1×10-4 S·m-1。
(编写:杨朝霞 校核:刘文萍)