实验八十 线性电位扫描法测定镍在硫酸溶液中的钝化行为
一、实验目的
(1)了解金属钝化行为的原理和测量方法;
(2)掌握用线性电位扫描法测定镍在硫酸溶液中的阳极极化曲线和钝化行为;
(3)测定C1-浓度对Ni钝化的影响。
二、实验原理
1、金属的钝化
金属处于阳极过程时会发生电化学溶解,其反应式为:
M → Mn+ + ne-
在金属的阳极溶解过程中,其电极电势必须大于其热力学电势,电极过程才能发生。这种电极电势偏离其热力学电势的行为称为极化。当阳极极化不大时,阳极过程的速率(即溶解电流密度)随着电势变正而逐渐增大,这是金属的正常溶解。但当电极电势正到某一数值时,其溶解速率达到最大,而后,阳极溶解速率随着电势变正,反而大幅度降低,这种现象称为金属的钝化。
金属钝化一般可分为两种。若把铁浸入浓硝酸(d>1.25)中,一开始铁溶解在酸中并放出NO,这时铁处于活化状态。经过一段时间后,铁几乎停止了溶解,此时的铁即使放在硝酸银溶液中也不能置换出银,这种现象被称为化学钝化。另一种钝化称为电化学钝化,即用阳极极化的方法使金属发生钝化。金属处于钝化状态时,其溶解速率较小,一般为10-6-10-8A·cm-2。
金属之所以会由活化状态转变为钝化状态,至今还存在着不同的观点。有人认为金属钝化是由于金属表面形成了一层具有保护性的致密氧化物膜,因而阻止了金属进一步溶解,称为氧化物理论;另一种观点则认为金属钝化是由于金属表面吸附了氧,形成了氧吸附层或含氧化物吸附层,因而抑制了腐蚀的进行,称为表面吸附理论;第三种理论认为,开始是氧的吸附,随后金属从基底迁移至氧吸附膜中,然后发展为无定形的金属-氧基结构而使金属溶解速率降低,被称为连续模型理论。
2、影响金属钝化过程的几个因素
(1)溶液的组成
溶液中存在的H+、卤素离子以及某些具有氧化性的阴离子对金属钝化现象起着显著的影响。在中性溶液中,金属一般是比较容易钝化的;而在酸性或某些碱性溶液中要困难得多。这与阳极反应产物的溶解度有关。卤素离子,特别是C1-的存在,则明显地阻止金属的钝化过程,且已经钝化了的金属也容易被它破坏(活化),这是因为C1-的存在破坏了金属表面钝化膜的完整性。溶液中如果存在具有氧化性的阴离子(如CrO42-),则可以促进金属的钝化。溶液中的溶解氧则可以减少金属上钝化膜遭受破坏的危险。
(2)金属的化学组成和结构
各种纯金属的钝化能力均不相同,以Fe、Ni、Cr种金属为例,易钝化的顺序Cr>Ni>Fe。因此,在合金中添加一些易钝化的金属,则可提高合金的钝化能力和钝态的稳定性。不锈钢就是典型的例子。
(3)外界因素
当温度升高或加剧搅拌,都可以推迟或防止钝化过程的发生。这显然是与离子的扩散有关。在进行测量前,对研究电极活化处理的方式及其程度也将影响金属的钝化过程。
3、研究金属钝化的方法
电化学研究金属钝化通常有两种方法:恒电流法和恒电势法。由于恒电势法能测得完整的阳极极化曲线,因此,在金属钝化研究中比恒电流法更能反映电极的实际过程。用恒电势法测量金属钝化可有下列两种方法。
(1)静态法
将研究电极的电势恒定在某一数值,同时测量相应极化状况下达到稳定后的电流。如此逐点测量一系列恒定电势时所对应的稳定电流值,将测得的数据绘制成电流-电势图,从图中即可得到钝化电位。
(2)动态法
将研究电极的电势随时间线性连续地变化(见图1),同时记录随电势改变而变化的瞬时电流,就可得完整的极化曲线图。所采用的扫描速率(单位时间电势变化的速率)需根据研究体系的性质而定。一般来说,电极表面建立稳态的速度愈慢,则扫描速度也应愈慢,这样才能使所测得的极化曲线与采用静态法的相近。
上述两种方法,虽然静态法的测量结果较接近静态值,但测量时间太长,所以,在实际工作中常采用动态法来测量。本实验亦采用动态法。
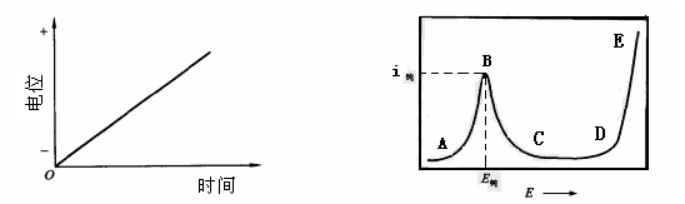
图80-1 线性电势扫描信号示意图 图 80-2 钝化曲线示意图
用动态法测量金属的阳极极化曲线时,对于大多数金属均可得到如图2所示的形式。图中的曲线可分为四个区域:
①AB段为活性溶解区,此时金属进行正常的阳极溶解,阳极电流随电势的变化符合塔菲尔(Tafel)公式。
②BC段为过渡钝化区,电势达到B点时,电流为最大值,此时的电流称为钝化电流(i钝), 所对应的电势称为临界电势或钝化电势(E钝)。电势过B点后,金属开始钝化,其溶解速率不断降低并过渡到钝化状态(C点之后)。
③CD段为稳定钝化区,在该区域中金属的溶解速率基本上不随电势而改变。此时的电流称为钝态金属的稳定溶解电流。
④DE段为过钝化区,D点之后阳极电流又重新随电势的正移而增大,此时可能是高价金属离子的产生;也可能是水的电解而析出O2;还可能是两者同时出现。
三、实验仪器与试剂
1、仪器
CHI电化学分析仪(包括计算机)1台,研究电极(直径为0.5cm的Ni圆盘电极)1支,饱和甘汞电极1支(0.1mol·L-l H2SO4作盐桥),辅助电极1支(Pt丝电极),三电极电解池1个,金相砂纸(02﹟和06﹟ )。
2、实验试剂
0.1mol·L-l H2SO4溶液,1mol·L-l KCl溶液,蒸馏水。
 四、实验步骤
四、实验步骤
本实验用线性电势扫描法分别测量Ni在0.1 mol·L-l H2SO4、0.1 mol·L-l H2SO4+0.01 mol·L-l KCl、0.1 mol·L-l H2SO4+0.04 mol·L-l KCl和0.1 mol·L-l H2SO4+0.1 mol·L-l KCl在溶液中的阳极极化曲线。
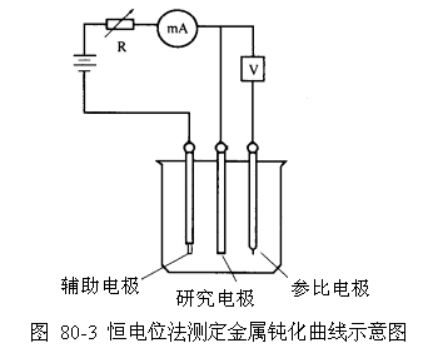
打开仪器和计算机的电源开关,预热10min。研究电极用06﹟金相砂纸打磨后,用重蒸馏水冲洗干净,擦干后将其放入已洗净并装有0.1 mol·L-l H2SO4溶液的电解池中。分别装好辅助电极和参比电极,并按图3接好测量线路(红色夹子接辅助电极;绿色接研究电极;白色接参比电极)。
通过计算机使CHI仪器进入Windows工作界面;在工具栏里选中“Control”,此时屏幕上显示一系列命令的菜单,再选中“Open Circuit Potential”,数秒钟后屏幕上即显示开路电势值(镍工作电极相对于参比电极的电势),记下该数值;在工具栏里选中“T’’(实验技术),此时屏幕上显示一系列实验技术的菜单,再选中“Linear Sweep Voltammetry(线性电势扫描法)”;然后在工具栏里选中“参数设定”(在“T”的右边),此时屏幕上显示一系列需设定参数的对话框:
◆ 初始电势(Init E)——设定为比先前所测得的开路电势负0.1V;
◆ 终止电势(Final E)——设为1.4V;
◆ 扫描速率(Scan Rate)——定为0.01 V·s-1;
◆ 采样间隔(Sample Interval)——0.01 V;
◆ 初始电势下的极化时间(Quiet Time)——设为300s;
◆ 电流灵敏度(Sensitivity)——设为0.001A(1E-3A)。
至此参数已设定完毕,点击“OK”键;然后点击工具栏中的运行键,此时仪器开始运行,屏幕上即时显示极化时间值(即在初始电势下阴极极化),300s后显示当时的工作状况和电流随电势的变化曲线。扫描结束后点击工具栏中的“Graphics”,再点击“Graph Option”,在对话框中分别填上电极面积和所用的参比电极及必要的注解,然后在“Graph Option”中点击“Present Data Plot”显示完整的实验结果。给实验结果取个文件名存盘。
在原有的溶液中分别添加KCl使之成为0.1 mol·L-l H2SO4+0.01 mol·L-l KCl、0.1 mol·L-l H2SO4+0.04 mol·L-l KCl和0.1 mol·L-l H2SO4+0.1 mol·L-l KCl溶液,重复上述步骤进行测量。每次测量前工作电极必须用金相砂纸打磨和清洗干净。
五、注意事项
(1)每次测量前工作电极必须用金相砂纸打磨和清洗干净。
(2)本实验中当KCl浓度≥0.02 mol·L-l时,钝化电流会明显增大,而稳定钝化区间(CD段)会减小,此时的过钝化电流(DE段)也会明显增大,为了防止损伤工作电极,一旦当DE段的电流达到3-4mA时应及时停止实验,此时只需点击工具栏中的停止键“■”即可。
(3)在电化学测量实验中,常用电流密度代替电流,因为电流密度的大小就是电极反应的速率。同时实验图中电位铀上应标明是相对于何种参比电极。
六、实验记录与处理
(1)分别在极化曲线图上找出E钝、i钝及钝化区间,并将数据记录到表80-1中。
表 80-1 实验结果记录表
溶液组成 |
开路电位(V) |
初始电位(V) |
钝化电位E钝 / V |
钝化电流i钝 / mA |
钝化稳定区间(CD) |
钝化稳定区电流i钝 / mA |
|
|
|
|
|
|
|
(2)点击工具栏中的“Graphics”,再点击“Overlay Plot”,选中另3个文件使4条曲线叠加在一张图中,如果曲线溢出画面,可在“Graph Option”里选择合适的X、Y轴量程再作图,然后打印曲线,打印前须将打印格式设定为“横向”。
(3)比较4条曲线,并讨论所得实验结果及曲线的意义。
七、思考题
(1)在测量前,为什么电极在进行打磨后,还需进阴极极化处理?
(2)如果扫描速率改变,测得的E钝和i钝有无变化?为什么?
(3)当溶液pH发生改变时,Ni电极的钝化行为有无变化?
(4)在阳极极化曲线测量线路中,参比电极和辅助电极各起什么作用?
参考文献
[1] 周伟肪主编.电化学测量[M].上海:上海科技出版社,1984.
[2] 复旦大学等编,庄继华等修订.物理化学实验(第三版)[M].北京:高等教育出版社,2004.
(编写:刘文萍 校核:杨朝霞)