实验八十二 电导法测定乙酸乙酯皂化反应的速率常数
一、实验目的
(1)了解二级反应的特点,学会用图解法求取二级反应速率常数;
(2)用电导法测定乙酸乙酯反应速率常数,了解反应活化能的测定方法;
(3)掌握测量原理,并熟悉电导率仪的使用。
二、实验原理
乙酸乙酯皂化反应是一个二级反应,其反应式为:
CH3COOC2H5 +Na+ + OH- → CH3COO - + Na+ +C2H5OH
在反应过程中,各物质的浓度随时间而改变。某一时刻的OH-离子浓度可用标准酸进行滴定求得,也可以通过测量溶液的某些物理性质而求出。用电导率仪测定溶液的电导率值κ随时间的变化关系,可以监测反应的进程,进而可求算反应的速率常数。二级反应的速率与反应物的浓度有关。为了处理方便起见,在设计实验时将反应物CH3COOC2H5和NaOH采用相同的浓度c作为起始浓度。当反应时间为t时,反应所生成的CH3COO-和C2H5OH的浓度为x,那么CH3COOC2H5和NaOH的浓度则为(c-x)。设逆反应可忽略,则反应物和生成物的浓度随时间的关系为:
CH3COOC2H5 + NaOH → CH3COONa+C2H5OH
t = 0: c c 0 0
t = t: c-x c-x x x
t →∞: →0 →0 →c →c
对于上述二级反应的速率方程可表示为:
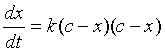 (1)
(1)
积分得:
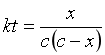 (2)
(2)
显然,只要测出反应进程中t时的x值,再将c代入上式,就可以算出反应速率常数k值。
由于反应是在稀的水溶液中进行的,因此,可以假定CH3COONa全部电离。溶液中参与导电的离子有Na+、OH-和CH3COO-等,而Na+在反应前后浓度不变,OH-的迁移率比CH3COO-的迁移率大得多。随着反应时间的增加,OH-不断减少,而CH3COO-不断增加,所以,体系的电导率值不断下降。在—定范围内,可以认为体系电导率值的减少与CH3COONa的浓度x的增加量成正比,即
t = t: x = β(κ0-κt) (3)
t →∞: c = β(κt-κ∞) (4)
式中κ0为t=0溶液的初始电导率值,κt为t=t时溶液的电导率值,κ∞为t→∞,即反应完全后溶液的电导率值,β为比例常数。将x及c与电导率的关系式分别代入积分式得:
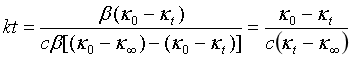 (5a)
(5a)
或写成:
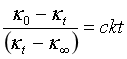 (5b)
(5b)
从直线方程式(5b)可知,只要测定了κ0、κ∞以及一组相应于t时κt值,以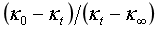 对t作图,可得一直线,由直线的斜率即可求得反应速率常数k值,k的单位为min-1·mol-1·L。
对t作图,可得一直线,由直线的斜率即可求得反应速率常数k值,k的单位为min-1·mol-1·L。
(5b)式也可整理为:
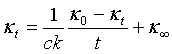 (5c)
(5c)
从直线方程式(5c)可知,只要测定了κ0以及一组相应于t时κt值,以κt对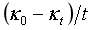 作图,也可得一直线,由直线的斜率即可求得反应速率常数k值。利用(5c)式可以不要测定κ∞值。
作图,也可得一直线,由直线的斜率即可求得反应速率常数k值。利用(5c)式可以不要测定κ∞值。
根据阿仑尼乌斯(Arrhenius)公式
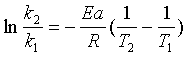 (6)
(6)
式中k1,k2分别为温度T1,T2时测得的反应速率常数,R是摩尔气体常数,Ea为反应活化能。如果测定两个不同温度下的反应速度常数,就得从(6)式求算出反应活化能。
三、实验仪器与试剂
1、仪器
恒温槽(CH1015上海恒平)1台、数字式电导仪(DDS-307上海日岛)1台、双管电导池2个、停表1支、移液管(10mL)3支、容量瓶(50mL)1个
2、实验试剂
NaOH(分析纯) CH3COONa(分析纯) CH3COOC2H5(分析纯)。
四、实验步骤
(1)启用恒温槽,调节至实验所需温度。
(2)配制溶液
 分别配制0.0100mol·L-1NaOH 、0.0200mol·L-1NaOH、0.0100mol·L-1CH3COONa和0.0200mol·L-1CH3COOCOOC2H5各50mL。
分别配制0.0100mol·L-1NaOH 、0.0200mol·L-1NaOH、0.0100mol·L-1CH3COONa和0.0200mol·L-1CH3COOCOOC2H5各50mL。
(3)调节电导率仪。
(4)溶液起始电导率κ0的测定
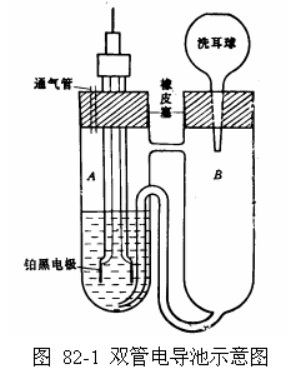
本实验采用双管电导池进行测量,其装置如图82-1所示。先将铂黑电极取出,浸入电导水中。
①将双管电导池洗净烘于,加入适量0.0100mo1·L-1NaOH溶液(浸没铂黑电极并超出1cm)。
②将铂黑电极取出,用相同浓度的Na0H溶液淋洗电极,不要碰电极上的铂黑),然后插入电导池中。
③将整个系统置于恒温水浴中,恒温约10min。
④测量该溶液的电导值,每隔2min读一次数据,读取三次。
⑤更换溶液,重复测量,如果两次测量在误差允许范围内,可取平均值作κ0。注意:每次更换电导池中的溶液时,都要先用电导水淋洗电极和电导池,接着再用被测溶液淋洗2至3次。
(5)κ∞的测量
实验测定中,不可能等到t→∞,且反应也并不完全不可逆,故通常以0.0100mol·L-1 CH3COONa 溶液的电导值κ∞,测量方法与κ0的测量相同。
(6)κt的测量
①将电导池和铂电极用电导水洗净吹干,此时不能用待测液润洗,否则会影响反应物浓度。安装后置于恒温水浴内。
②用移液管吸取10ml0.0200mol·L-1 NaOH注入A管中;用另一支移液管吸取10ml 0.0200mol·L-1CH3COOC2H5溶液注入B管中,塞上橡皮塞,恒温10min。
③用洗耳球通过B管上口将CH3COOC2H5溶液压入A管(注意,不要用力过猛),与NaOH溶液混合。当溶液压入一半时,开始记录反应时间。反复压几次,使溶液混合均匀,并立即开始测量其电导值。
④每隔2min读一次数据,直至电导数值变化不大时(一般反应时间为45min至1h),可停止测量。
⑤反应结束后,倾去反应液,洗尽电导池和电极。重新测量κ∞。如果测量结果与前一次的基本相同,则可进行下一步的实验。
(7)反应活化能的测定
按上述操作步骤测定另一温度下的反应速率常数,用阿仑尼乌斯公式,计算反应活化能。
五、注意事项
(1)本实验需用电导水,并避免接触空气及灰尘杂质落入。
(2)配好的NaOH溶液要防止空气中的CO2气体进入。
(3)乙酸乙酯溶液和NaOH溶液浓度必须相同。
(4)乙酸乙酯溶液需临时配制,配制时动作要迅速,以减少挥发损失。
(5)小心使用所有玻璃皿和电极,防止损坏。
(6)实验温度要控制准确。
六、实验记录与处理
(1)根据实验测定结果,分别以(κ0-κt)/(κt-κ¥)对t作图,并从直线斜率计算不同温度下的反应速率常数k1,k2。
(2)根据公式(6)计算反应的活化能Ea。
(3)文献值
表 82-1 温度对乙酸乙酯皂化反应速率常数的影响[4]
c/ mol·L-1 |
t/℃ |
k /L·mol-1·s-1 |
k/ L·mol-1·min-1 |
Ea/ KJ·mol-1 |
|
0 |
8.65×10-3 |
0.519 |
61.1 |
0.01 |
10 |
2.35×10-2 |
1.41 |
|
19 |
5.03×10-2 |
3.02 |
0.021 |
25 |
|
6.85 |
|
八、思考题
(1)反应分子数和反应级数是两个充全不同的概念,反应级数只能通过实验来确定。试问如何从实验结果来验证乙酸乙酯皂化反应为二级反应?
(2)乙酸乙酯皂化反应为吸热反应,试问在实验过程中如何处置这一影响而使实验得到较好结果?
(3)如果NaOH和CH3COOC2H5溶液为浓溶液时,能否用此法求k值,为什么?
参考文献
[1] F.Daniels, R.A.A1berty, J.W.williams,ed.Harriman.Expermental Physical Chemistry[M]. New York:McGraw-Hill,Inc,1975.
[2] 傅献彩,沈文霞,姚天场编.物理化学(下册,第五版)[M].北京:高等教育出版社,2005.
[3] 冯安春,冯喆.简化电导法测量乙酸乙酯皂化反应速率常数[J].化学通报,1986,49(3):55.
[4] 复旦大学等编,庄继华等修订.物理化学实验(第三版)[M].北京:高等教育出版社,2004.
附录一 讨论
(1)在NaOH的初始浓度a略大于CH3COOC2H5初始浓度b的情况下,可以推导出:
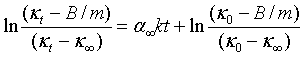 (7)
(7)
式中B和m分别与有关离子的摩尔电导率λ以及Na0H的初始浓度a有关:
B = 1/(λOH- - λAc-)
m=a(λNa+ + λAc-)/ (λOH- - λAc-) (8)
a∞根据反应终了时的pH值求算:
1g a∞=pH-14 (9)
这样只要以1n[(κt-B/m)/( κt-κ∞)]对t作图,由斜率即可计算反应速率常数k。利用这个方法甚至无需精确测定反应体系中乙酸乙酯浓度,也可计算出k值。
(2)由于空气中的CO2会溶入电导水和配制的Na0H溶液中,而使溶液浓度发生改变。因此在实验中可用煮沸的电导水,同时可在配好的NaOH溶液瓶上装配碱石灰吸收管等方法处理。由于CH3COOC2H5溶液水解缓慢,且水解产物又会部分消耗NaOH,故所用溶液都应新鲜配制。
(3)溶液的电导值的大小,表明导电能力的强弱,其物理念义为电阻的倒数。实际上它与所用的电极面积A和电极之间的距离l有关:
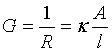 (10)
(10)
式中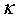 称为电导率,单位为S·m-1,G的单位为Ώ-1。
称为电导率,单位为S·m-1,G的单位为Ώ-1。
电导池所用的铂黑电极的表面积无法直接测定,故常用已知电导率的溶液(如KCl溶液)对电导池进行标定。
(编写:杨朝霞 校核:刘文萍)