乙醚的制备
一、实验目的
1. 掌握实验室制备乙醚的原理和方法。
2. 初步掌握底沸点易燃液体的操作要点。
二、实验原理
主反应:
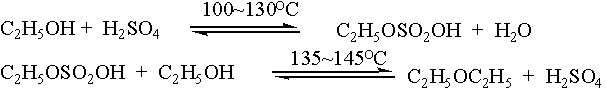
总反应:

副反应:
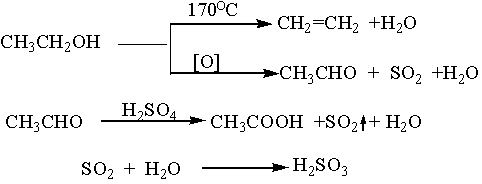
三、实验试剂
95%乙醇 浓硫酸 5%氢氧化钠溶液 饱和氯化钠溶液 饱和氯化钙溶液 无水氯化钙
四、实验步骤
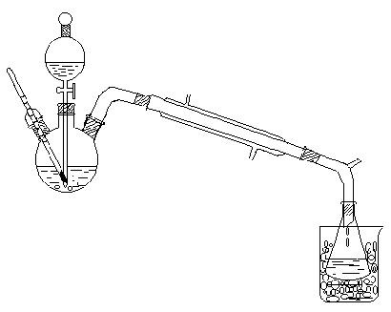
1、在100 ml干燥的三口瓶中加入12mL 95 %乙醇,将烧瓶浸入冰水入中冷却,缓慢加入12 ml浓硫酸混匀。
2、滴液漏斗内盛有25 ml 95 %乙醇,漏斗脚末端与温度计的水银球必须浸入液面以下距瓶底约0.5~1cm,加入2 粒沸石,接受器浸入冰水中冷却,接尾管的支管接橡皮管通入下水道。
3、将反应瓶在石棉网上加热,使反应瓶温度比较迅速上升到140 ℃后,开始由滴液漏斗慢慢滴加乙醇,控制滴加速度与馏出液速度大致相等(1d/s),维持反应温度在135~145 ℃,约0.5 h滴加完毕,再继续加热,直到温度上升到160 ℃,去掉热源停止反应。
4.将馏出液转入分液漏斗,依次用8 ml 5 % NaOH溶液、8 ml饱和NaCl溶液、8ml×2饱和CaCl2溶液洗涤。
5、无水氯化钙干燥至澄清,分出醚,在水浴中蒸馏收集33-380C馏液,约8g。
6、计算产率
五、实验装置
六、操作重点及注意事项
1、分批加浓硫酸,边加边摇边冷却,防止乙醇氧化。
2、装置要严密,反应完后要先停加热,稍冷却后再拆下接受器,防止产物挥发。
3、控制好反应温度及滴加乙醇的速度1d/s。
4、洗涤时注意顺序,室内无明火。
5、不得将氯化钙带入烧瓶中蒸馏,水浴蒸馏,不得有明火。
6、实验完毕,关好水电。
七、问题讨论
1、本实验中,把混在粗制乙醚里的杂质一一除去采用那些措施?
2、 反应温度过高或过低对反应有什么影响?
3、 反应中可能产生的副产物是什么?各步洗涤的目的何在?
八、主要试剂及产品的物理常数:(文献值)
名称 |
分子量 |
性状 |
折光率 |
比重 |
熔点℃ |
沸点℃ |
溶解度:克/100ml溶剂 |
水 |
醇 |
醚 |
浓H2SO4 |
98.08 |
无色 液体 |
|
1.84 |
10.35 |
340 |
|
|
|
乙醚 |
74.12 |
无色透明液体 |
1.3526 |
0.7097 |
-89.12 |
34.5 |
能溶 |
混溶 |
混溶 |
乙醇 |
46.07 |
无色透明液体 |
1.36 |
0.780 |
-114.5 |
78.4 |
∞ |
∞ |
∞ |