熔点的测定
一、实验目的
1、了解熔点测定的意义。
2、掌握熔点测定的操作方法。
二、实验原理
熔点是固体有机化合物固液两态在大气压力下达成平衡的温度,纯净的固体有机化合物一般都有固定的熔点,固液两态之间的变化是非常敏锐的,自初熔至全熔(称为熔程)温度不超过0.5-1℃。
化合物温度不到熔点时以固相存在,加热使温度上升,达到熔点时,开始有少量液体出现,此后,固液两相平衡。继续加热,温度不再变化,此时加热所提供的热量使固相不断转变为液相,两相间仍为平衡,最后的固体熔化后,继续加热则温度线性上升。因此在接近熔点时,加热速度一定要慢,每分钟温度升高不能超过2℃,只有这样,才能使整个熔化过程尽可能接近于两相平衡条件,测得的熔点也越精确。
三、实验试剂
浓H2SO4 AR尿素 AR肉桂酸(C6H5CH=CHCOOH) 尿素与肉桂酸的等量混合物
四、实验步骤
测定熔点的方法很多,本实验采用毛细管法。
1、熔点管的制备
毛细管的内径约为1-2mm,长约50-70mm。毛细管一端用小火封闭,直至毛细管封闭端的内径有两条细线相交或无毛细现象。
2、样品的装入
取少量(约0.1克)待测熔点的干燥样品(尿素)于干净干燥的表面皿上研成粉末,将毛细管开口一端插入粉末中,再使开口一端向上轻轻在桌面上敲击,使粉末落入管底。亦可将装有样品的毛细管反复通过一个长玻管,自由落下,这样也可使样品很均匀地落入管底。样品高约2—3毫米。样品必须均匀地落入管底,否则不易传热,影响测定结果。沾附于毛细管外壁的粉末必须拭去,以免污染Thiele管中的热浴液。
3、仪器安装
Thiele管(又叫b 形管)盛浓硫酸作为热浴液,浓硫酸装到与侧管口相平或略高于侧管。将Thiele管用铁夹固定在铁架台上,塞上带有三角缺口的软木塞,将温度计插入软木塞中央孔中其刻度对着软木塞缺口,以便观察温度。使温度计水银球部恰好处于提勒氏管上下两个叉管口中部。调整好上述装置后将温度计连同软木塞一同取下,借助温度计上蘸有的液体硫酸,小心地将装好样品的毛细管粘附在温度计上,并用橡皮圈固定,注意使样品部分正贴着水银球中部,然后轻轻将附有毛细管的温度计及软木塞按原位置插入Thiele管中。
4、熔点的测定
熔点测定的操作关键是加热速度,以每分钟上升5oC的速度升温至熔点下约l5oC时,减缓加热速度,使温度上升速度每分钟约l-2oC为宜。当接近熔点时,加热要更慢,每分钟约上升0.2~0.3oC,此时应特别注意温度的上升和毛细管中样品的情况。记录当毛细管中样品开始蹋落并有液相产生时(初熔)和固体完全消失时(全熔)的温度,此即为样品的熔点。
五、实验装置
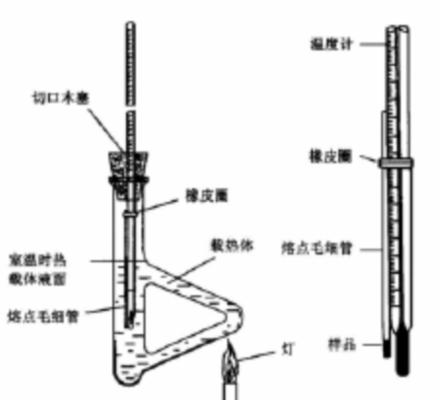
六、操作重点及注意事项
1、本实验采用浓硫酸做热浴,应特别小心,不仅要防止灼伤皮肤,还要注意使样品或其他有机物触及硫酸,填装样品时,沾在管外的样品必须拭去,以免硫酸的颜色变黑。
2、样品的填装必须紧密结实,高度约2-3mm。
3、熔点测定时,注意使温度计水银球位于b形管上下两叉口之间。
4、每一次测定都必须使用新的熔点管新装样品,不能使用已测过的熔点的样品管。
5.温度计从硫酸中取出不得马上用水冲洗,否则温度计将破裂。
6、控制升温速度,并记录样品熔点范围。
7、实验完毕,关好水电。
七、问题讨论
1.熔点测定有何意义?
2.第一次测定熔点时已经熔化后经冷却又固化的有机物是否可以再作第二次熔点测定?
3.测定熔点造成的误差与哪些因素有关?怎样控制升温速度?
八、主要试剂及产品的物理常数:(文献值)
名 称 |
分子量 |
性状 |
折光率 |
比重 |
熔点℃ |
沸点℃ |
溶解度:克/100ml溶剂 |
水 |
醇 |
醚 |
尿素 |
60.06 |
|
|
1.3230 |
135℃ |
分解 |
|
|
|
肉桂酸 |
148.16 |
|
|
1.249 |
133℃ |
300℃ |
|
|
|